کاربرد پلیمرهای زیستتخریبپذیر سنتزی در تجهیزات پزشکی

در نیمه اول این قرن، تحقیقات بر روی مواد سنتز شده از اسید گلایکولیک و دیگر اسیدهای آلفا هیدروکسی کنار گذاشته شد زیرا پلیمرهای بهدستآمده برای استفاده صنعتی طولانیمدت بسیار ناپایدار بودند. بااینحال این ناپایداری منجر به زیستتخریبپذیری در سه دهه گذشته در کاربردهای پزشکی بسیار مهم بوده است. پلیمرهای تهیهشده از اسید گلایکولیک و اسیدلاکتیک کاربردهای زیادی را در صنعت پزشکی پیدا کردند. شروع آن با بخیههای زیستتخریبپذیر بود که برای اولین بار در 1960 تأیید شد.
از آن زمان محصولات متنوع مبتنی بر اسیدلاکتیک، اسید گلایکولیک و دیگر مواد شامل پلیدیاکسانون، کوپلیمرهای پلیتریمتیلنکربنات، هموپلیمرهای (ε-caprolactone) و کوپلیمرهای آن برای استفاده بهعنوان تجهیزات پزشکی پذیرفتهشدهاند. علاوه بر این موارد تأییدشده، تحقیقات زیادی در مورد پلیانیدریدها، پلیاورتواسترها، پلیفسفاژنها و دیگر پلیمرهای زیستتخریبپذیر ادامه دارد. شکل زیر یک نمونه اولیه درون عروقی از آمیزه پلیلاکتاید و تریمتیلنکربنات را نشان میدهد.

چرا یک متخصص پزشکی (پزشک) تمایل دارد این مواد تخریب شوند؟ دلایل مختلفی ممکن است وجود داشته باشد اما اساسیترین آنها با خواست پزشک برای داشتن وسیلهای است که میتواند بهعنوان کاشت (ایمپلنت) مورداستفاده قرار گیرد و نیازی به مداخلات جراحی ثانویه برای برداشتن نداشته باشد. در کنار حذف جراحی ثانویه، زیستتخریبپذیری، ارائهدهنده دیگر مزایا است. بهعنوانمثال یک استخوان شکسته که با یک ایمپلنت ضدزنگ سخت ثابتشده است، با برداشتن ایمپلنت تمایل به شکست مجدد دارد. ازآنجاکه تنش توسط فولاد ضدزنگ تحمل میشود، استخوان قادر به تحمل بار کافی در طول روندترمیم نیست. بااینحال ایمپلنت تهیهشده از پلیمر زیستتخریبپذیر میتواند بهگونهای مهندسی شود که بهتدریج بار را به استخوان در حال ترمیم منتقل کند. استفاده هیجانانگیز دیگر برای پلیمرهای زیستتخریبپذیر، پتانسیل فوقالعاده را ارائه میدهد که اساس رهایش دارو است (یا بهتنهایی بهعنوان یک سیستم آزادسازی دارو و یا در ارتباط با عملکرد یک دستگاه پزشکی است). دانشمندان پلیمر طی 30 سال گذشته پیشرفتهای شگرفی را درزمینه پزشکی و تجهیزات داشتهاند. این مقاله بر تعدادی از این تحولات تمرکز میکند. ما همچنین شیمی پلیمرها ازجمله سنتز و تخریب را مرور میکنیم و توضیح میدهیم که چگونه میتوان خواص را با کنترلهای سنتزی مناسب نظیر ترکیب کوپلیمر و تجهیزات ویژه برجسته برای فرآیند و جابهجایی کنترل کرد و برخی از دستگاههای تجاری بر اساس این مواد را موردبحث قرار دارد.
شیمی پلیمر
پلیمرهای زیستتخریبپذیر میتوانند طبیعی و یا سنتزی باشند. بهطورکلی، پلیمرهای سنتزی مزایای بیشتری نسبت به مواد طبیعی ارائه میدهند، زیرا میتوانند طیف وسیعتری از خواص و یکنواختی قابل پیشبینیتری را نسبت به مواد طبیعی به دست آورند. پلیمرهای مصنوعی همچنین منبع قابلاطمینانتری از مواد اولیه بدون هیچگونه نگرانی از ایمنیزایی را نشان میدهند. جدول زیر خواص پلیمرهای زیستتخریبپذیر رایج را نشان میدهد.
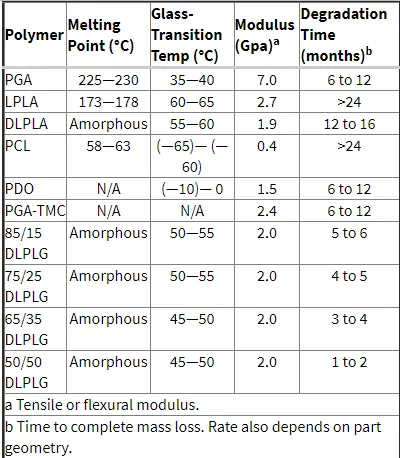
معیارهای کلی برای انتخاب یک پلیمر برای استفاده بهعنوان یک ماده زیستی، تطابق خواص مکانیکی و زمان تخریب با نیازهای مورد درخواست است (جدول) پلیمر ایدهآل برای یک کاربرد خاص به اینگونه تنظیم میشود که:
- خواص مکانیکی مطابق با کاربرد دارد و تا زمانی که بافت اطرافترمیم میشود بهاندازه کافی مستحکم میماند.
- پاسخ سمی یا التهابی ایجاد نمیکند.
- پس از انجام کار (تحقق یافتن هدف) در بدن متابولیزه میشود و اثری بر جای نمیگذارد.
- بهراحتی در شکل محصول نهایی قابلپردازش است.
- ماندگاری قابل قبولی را از خود نشان میدهد.
- بهراحتی استریل میشود.
عوامل مؤثر بر کارایی مکانیکی پلیمرهای زیستتخریبپذیر بهخوبی برای دانشمندان پلیمر شناختهشدهاند و شامل انتخاب منومر، انتخاب آغازگر، شرایط فرآیند و حضور افزودنی میشود. این عوامل بهنوبه خود بر آبدوستی، بلورینگی، دمای ذوب و انتقال شیشهای، وزن مولکولی، توزیع وزن مولکولی، گروههای انتهایی، توالی توزیع (تصادفی در مقابل بلوکی) و وجود منومر باقیمانده یا افزودنیها تأثیر میگذارد. علاوه بر این، دانشمند پلیمری که با مواد زیستتخریبپذیر کار میکند میبایست هرکدام از این متغیرها را برای تأثیر آن بر زیستتخریبپذیری ارزیابی کند. تخریب زیستی با استفاده از پلیمرهای سنتزی که دارای پیوندهای هیدرولیتیک ناپایدار در پیکره خود هستند، انجامشده است. رایجترین گروههای عاملی شیمیایی با این مشخصه استرها، انیدریدها، اورتواسترها و آمیدها هستند. ما اهمیت خواص مؤثر بر زیستتخریبپذیری را بعداً در مقاله موردبحث قرار خواهیم داد.
بخش زیر مروری بر پلیمرهای زیستتخریبپذیر سنتزی دارد که در حال حاضر مورداستفاده یا بررسی در بستن زخم (بخیه و منگنه کردن)، دستگاههای تثبیت ارتوپدی (پینها، میلهها، پیچها، چسبها و رباطها)، کاربردهای دندانپزشکی (بازسازی بافت هدایتشده)، کاربردهای قلبی عروقی (استنت و پیوند) و کاربردهای رودهای (حلقههای پیونددهنده) قرار میگیرند. بیشتر تجهیزات زیستتخریبپذیر تجاری در دسترس پلیاسترهایی هستند که از هموپلیمرها یا کوپلیمرهای گلیکولید و لاکترید تشکیلشدهاند. همچنین تجهیزاتی ساختهشده از کوپلیمرهای تریمتیلنکربنات و ε-caprolactone و یک محصول بخیه از پلیدیاکسانون وجود دارد.
پلی گلیکولید (PGA)
پلی گلیکولید سادهترین پلیاستر آلیفاتیک خطی است. PGA برای توسعه اولین بخیه قابلجذب سنتزی مورداستفاده قرار گرفت که تحت نام Dexon در 1960 توسط Davis و Geck به بازار عرضه شد. منومر گلیکولید از دیمریرزاسیون اسید گلیکولیک سنتز میشود. پلیمریزاسیون حلقهگشا مواد با وزن مولکولی بالا را تولید میکند که تقریبا 1% تا 3% منومر باقیمانده حضور دارد (شکل زیر). PGA بسیار بلورین (45% تا 55%) با نقطه ذوب بالا (220 تا 225) و دمای انتقال شیشهای 35 تا 40 درجه است. به دلیل درجه تبلور بالا در اکثر حلالهای آلی قابلحل نیست. موارد استثنا حلالهای آلی فلوئور دار مانند هگزافلوئوروپروپانول هستند. الیاف تهیهشده از PGA استحکام و مدول بالایی از خود نشان میدهند و بسیار سفت هستند و بهجز شکل بافتهشده میتوانند بهعنوان بخیه استفاده شوند. بخیههای PGA پس از دو هفته حدود 50% و پس از 4 هفته استحکام خود را از دست میدهند و پس از 4 تا 6 ماه بهطور کامل جذب میشوند. گلیکولید با منومرهای دیگر کوپلیمر شده است تا سختی الیاف حاصل را کاهش دهد.
پلیلاکتاید (PLA)
لاکترید دیمر حلقوی از اسید لاکتیک اسید است که بهعنوان دو ایزومر نوری d و I و وجود دارد. l-lactide ایزومر طبیعی است و dl-lactide از آمیزهی d-lactide و l-lactide سنتز شده است. هموپلیمر l-lactide (LPLA) یک پلیمر نیمه بلورین است. این مواد استحکام کششی بالا و ازدیاد طول کمی را از خود نشان میدهد و درنتیجه مدول بالایی دارند که آنها را برای کاربردهای باربر مانند تثبیت ارتوپدی و بخیه مناسبتر میکند. پلی (dl-lactide) (DLPLA) یک پلیمر بیشکل (آمورف) است که توزیع تصادفی از هر دو شکل ایزومری اسید لاکتیک را نشان میدهد و بر این اساس نمیتواند در یک ساختار بلوری سازمانیافته قرار گیرد. این مواد دارای استحکام کششی کمتر، ازدیاد طول بالاتر و زمان تخریب بسیار سریعتر هستند و بهعنوان یک سیستم رهایش دارو جذابیت بیشتری دارند. پلی (l-lactide) حدود 37% بلورین است. نقطه ذوب حدود 175 تا 178 درجه سانتیگراد و دمای انتقال شیشهای 60 تا 65 سانتیگراد دارد. زمان تخریب LPLA بسیار آهستهتر از DLPLA است و برای جذب کامل به بیش از دو سال زمان نیاز دارد. کوپلیمرهای l-lactide و dl-lactide تا بلورینگی l-lactide را منقطع کرده و روند تخریب را تسریع کنند.
پلی کاپرولاکتون(ε-caprolactone)
پلیمریزاسیون حلقهگشا ε-caprolactone یک پلیمر نیمه بلورین با نقطه ذوب 59 تا 64 درجه سانتیگراد و دمای انتقال شیشهای 60- درجه سانتیگراد را نتیجه میدهد (شکل). این پلیمر بهعنوان بافتی سازگار در نظر گرفتهشده است و بهعنوان یک بخیه زیستتخریبپذیر در اروپا مورداستفاده قرار میگیرد. ازآنجاکه هموپلیمر دارای زمان تخریب حدود 2 سال است، کوپلیمرها سنتز شدند تا سرعت جذب زیستی را تسریع کنند. بهعنوانمثال کوپلیمرهای ε-caprolactone با dl-lactide موادی با سرعت تخریب سریعتر را نتیجه میدهند. کوپلیمر بلوکی ε-caprolactone با گلایکولید موادی با سرعت تخریب سریعتر را به دست میدهند. این کوپلیمر بلوکی، سختی کمتری را در مقایسه با PGA خالص ارائه میدهد که بهعنوان بخیه تکرشتهای توسط شرکت Ethicon با نام تجاری Monacryl فروخته میشود.
پلی دیاکسانون (یک پلیاتر-استر)
پلیمریزاسیون حلقهگشا p-dioxanone (شکل) منجر به اولین بخیه سنتزی تکرشتهای بالینی آزمایششده موسوم به PDS (عرضهشده توسط Ethicon) شد. این ماده تقریباً بلورینگی 55% با دمای انتقال شیشهای 10- تا 0 درجه سانتیگراد دارد. این پلیمر میبایست در کمترین دمای ممکن فرآیند شود تا از گسست پلیمر به منومر جلوگیری شود. پلیدیاکسانون هیچ اثر حاد یا سمی در کاشت (ایمپلنت) نشان نداده است. بخیه تک رشته حدود 50% از استحکام اولیه خود را پس از 3 هفته از دست میدهد و طی 6 ماه جذب میشود و این مزیتی نسبت به Dexon و یا محصولات دیگر برای ترمیم تدریجی زخم ایجاد میکند.
پلی (lactide-co-glycolide)
با استفاده از خواص پلیگلایکولید و پلی (l-lactide) بهعنوان نقطه شروع، کوپلیمریزه کردن این دو منومر برای گسترش دامنه خواص هموپلیمر امکانپذیر است (شکل). کوپلیمرهای گلایکولید با پلی (l-lactide) و dl-lactide برای تجهیزات و کاربرد رهایش دارو توسعهیافتهاند. توجه به این نکته ضروری است که بین ترکیب کوپلیمر، خواص مکانیکی و خواص تخریب مواد رابطه خطی وجود ندارد. بهعنوانمثال یک کوپلیمر حاوی 50% گلایکولید و 50% dl-lactide از هریک از هموپلیمرها سریعتر تخریب میشوند (شکل). کوپلیمرهای l-lactide با 25 تا 70% گلاکولید آمورف هستند؛ دلیل آن قطع نظم زنجیره پلیمر توسط منومر دیگر است. یک کوپلیمر حاوی 90% گلایکولید و 10% l-lactide توسط Ethicon بهعنوان یک بخیه قابلجذب تحت نام تجاری Vicryl توسعه داده شد. طی 3 الی 4 ماه جذبشده اما کمی زمان ماندگاری بیشتر دارد.
شکل بالا نیمهعمر هموپلیمرهای PGA و PLA و کوپلیمرهای آن را در بافت موش کاشته شده را نشان میدهد.
کوپلیمرهای گلایکولید با تریمتیلنکربنات (TMC) که پلیگلیکونات نامیده میشود (شکل) هم بهصورت بخیه (Maxon توسط Davis و Geck ) و پیچ و مهره (Acufex Microsurgical, MA) تهیهشده است. بهطورمعمول بهصورت کوپلیمرهای بلوکی A-B-A در نسبت گلایکولید:TMC 1:2 با بلوک مرکزی گلایکولید-TMC (B) و بلوکهای انتهایی گلایکولید خالص (A) تهیه میشوند. این مواد انعطافپذیری بهتری نسبت به PGA خالص داشته و تقریباً در 7 ماه جذب میشوند. گلایکولید همچنین با TMC و p- dioxanone (Biosyn توسط United States Surgical corp, Norwalk,CT) پلیمریزه شده است تا یک بخیه ترپلیمر را ایجاد کند که طی مدت 3 تا 4 ماه جذب میشود و در مقایسه با الیاف PGA خالص سختی کاهشیافته را ارائه میدهد.
سایر پلیمرهای درحالتوسعه
در حال حاضر، تنها دستگاههای ساختهشده از هموپلیمرها یا کوپلیمرهای گلایکولید، لاکتیک، گاپرولاکتون، پارا دیاکسانون و تریمتیلنکربنات برای بازاریابی توسط FDA ترخیص شدهاند. بااینحال تعدادی از پلیمرهای دیگر برای استفاده بهعنوان مواد برای تجهیزات زیستتخریبپذیر در حال بررسی هستند. علاوه بر سازگاری آنها برای مصارف پزشکی، پلیمرهای زیستتخریبپذیر نامزدهای بسیار خوبی برای بستهبندی و سایر کاربردهای مصرفی هستند. تعدادی از شرکتها در حال بررسی روشهایی برای ساختن پلیمرهای زیستتخریبپذیر کمهزینه هستند. یکی از روشهای مهندسی زیستی سنتز پلیمرها با استفاده از میکروارگانیسمها برای تولید پلیاسترهای ذخیره کننده انرژی است. دو نمونه از این مواد پلیهیدروکسیبوتیرات (PHP) و پلیهیدروکسیوالرات (PHV) که بهصورت تجاری بهعنوان کوپلیمر با نام Biopol (Monsanto Co., St. Louis ) در دسترس هستند و برای استفاده در تجهیزات پزشکی موردمطالعه قرارگرفتهاند (شکل). هموپلیمر PHP بلوری و شکننده است، درحالیکه کوپلیمرهای PHP با PHV بلورینگی کمتر، انعطافپذیری بیشتر داشته و فرآیند آنها آسانتر است. این پلیمرها معمولاً برای زیستتخریبپذیری نیاز به حضور آنزیمها دارند اما میتوانند در طیف وسیعی از محیطها تجزیه شوند و برای چندین کاربرد زیست پزشکی در نظر گرفته میشوند.
استفاده از پلیآمینواسیدهای سنتزی بهعنوان پلیمر برای تجهیزات زیست پزشکی با توجه به موجود گسترده آنها در طبیعت، انتخاب منطقی به نظر میرسد. بااینحال در عمل پلیآمینواسیدهای خالص به دلیل بلورینگی بالا و همچنین دشوار شدن فرآیند آنها و درنتیجه تخریب نسبتاً آهسته کاربرد چندانی پیدا نکردند. با توجه به آنتیژنی بودن پلیمرها با بیش از 3 اسید آمینه در زنجیره، آنها برای استفاده در محیط In Vivo نامناسب میکند. برای برطرفسازی این مشکلات پلیآمینواسیدهای اصلاحشده با استفاده از مشتقات تیروسین سنتز شده است. بهعنوانمثال پلیکربناتهای مشتق شده از تیروسین موادی با استحکام بالا هستند که ممکن است بهعنوان ایمپلنتهای ارتوپدی سودمند باشند. همچنین امکان کوپلیمریزه پلیآمینواسیدها برای اصلاح خواص آنها وجود دارد. دستهای که بیشتر موردتحقیق قرار گرفتند پلیاسترآمیدها هستند.
جستجوی پلیمرهای جدید برای رهایش دارو ممکن است پتانسیل کاربرد در دستگاههای پزشکی را نیز داشته باشد. در رهایش دارو دانشمند فرمولاسیون نهتنها به پایداری ماندگاری دارو بلکه به پایداری پس از کاشت نیز توجه دارد، خصوصاً زمانی که دارو ممکن است 1 تا 6 ماه یا حتی بیشتر در ایمپلنت بماند. در مورد داروهایی که ازنظر هیدرولیتیک ناپایدار هستند، ممکن است پلیمری که آب جذب میکند منع مصرف داشته باشد. محققان ارزیابی پلیمرهای آبگریز بیشتری را آغاز کردند که با فرسایش سطح نسبت به تجزیه هیدرولیتیک توده تخریب میشوند. دودسته از این پلیمرها پلیانیدریدها و پلیارتواسترها هستند. پلیانیدریدها از طریق دیهیدراسیون مولکولهای دیاسید به وسیله پلیمریزاسیون تراکمی مذاب سنتز شدهاند (شکل).
زمان تخریب را میتوان با توجه به آبگریزی منومر از روز تا سال تنظیم کرد. مواد در درجه اول از طریق فرسایش سطح تخریب میشوند و سازگاری عالی در بدن دارند. تاکنون آنها فقط برای فروش بهعنوان یک سیستم تحویل دارو تأییدشدهاند. محصول Gliadel که برای رهایش داروی شیمیدرمانی BCNU در مغز طراحیشده است در سال 1996 مجوز قانونی دریافت کرده و توسط شرکت Guilford Pharmaceuticals (Baltimore) تولید میشود. پلیارتواسترها برای اولین بار در سال 1970 توسط Alza Corp (Palo Alto, CA) و SRI International (Menlo Park, CA) در جستجوی پلیمرهای زیستتخریبپذیر سنتزی برای کاربردهای رهایش دارو موردبررسی قرار میگرفت (شکل).
این مواد چندین نسل بهبود را پشت سر گذاشتند و اکنون میتوانند در دمای اتاق بدون تشکیل محصولات جانبی تراکمی پلیمریزه شوند. پلی ارتواسترها آبگریز هستند و دارای پیوندهای هیدرولیتیک هستند که با اسید حساس است اما در بنیاد پایدار است. آنها با فرسایش سطح تجزیهشده و نرخ تخریب را میتوان با ترکیب مواد کمکی اسیدی یا پایه کنترل کرد.